重磅眼科生物药临床试验溃败 对康弘药业有哪些影响
康弘药业(002773.SZ)的重磅眼科生物药康柏西普临床试验宣告失败。4月10日,康弘药业发布公告,停止公司康柏西普眼用注射液的全球多中心临床试验。
康柏西普是一种抗VEGF(血管内皮生长因子)单抗融合蛋白,主要用于抑制病理性新生血管的形成,对应适应症主要包括湿性年龄相关性黄斑性病变(wAMD,已获批)。康柏西普在同类产品阿柏西普的结构基础上进行创新,从而实现跟少的给药频率并维持相似的临床疗效,实现了生物药的“me-better”。
2014年,康柏西普在国内获批上市,是国内最早一批上市的生物药之一。
公告内容显示,康柏西普将临床试验失败的原因归结为新冠疫情的影响。由于各国不断出台的各种管控措施,使得参与该临床试验的患者脱落、失访、超窗,完全符合给药方案的病例已逐步降低到不足入组病例的40%。
令人不解的是,该试验的启动时间是2018年5月,完成全部受试者主要重点访视的时间是2020年9月25日,受全球新冠疫情的影响约半年,却造成一半以上受试者无法完成给药方案的糟糕结果。
早有征兆
终止全球多中心临床试验并非没有预兆。3月29日,康弘药业发布公告称,公司收到法国国家药品与健康产品安全局(ANSM)停止康柏西普临床试验的相关公告。股价应声下跌,3月29、30两日累计跌幅超过40%。
康柏西普全球多中心临床试验曾被寄予厚望。按照此前公司预估,康柏西普的临床试验数据可用于美国、欧盟、日本等主要国际地区的上市申请。
早在2016年10月,康弘生物获得美国FDA(食品药品监督管理局)准许直接在美国开展康柏西普眼用注射液治疗wAMD适应症III期临床试验。这是国内药企极为罕见在美国I期、II期临床试验,直接获批开展III期临床试验的药品。
但这项临床试验的推进进度不尽如人意。直至2017年11月,康弘生物才与美国CRO(合同外包组织)达成临床试验协议。2018年5月,康弘生物才正式在欧美开展康柏西普的国际多中心III期临床试验。
在先期进度推进较慢的情况下,该试验完成所有受试者入组的时间是2019年12月。不巧的是,全球新冠疫情正在这个节点爆发,成为临床试验“溃败”的直接原因,而后将导致的连锁反应才刚刚开始。
对康弘药业有哪些影响?
康弘药业的主营业务分为传统中成药以及生物制药两部分。自上市以来,康柏西普已逐渐成为康弘药业的支柱品种。2019年康弘药业来自康柏西普销售额达11.55亿元,占比35.46%,其余收入来自化学药和中成药,收入分别为12.07亿元和8.92亿元。
对康弘药业而言,最直接的冲击来自资本支出与研发投入。2020年上半年,康弘药业在国际生产及研发中心建设项目(1期)在建给出账面价值达1.89亿元,预算投资额达12.28亿元。此外,同期康弘药业研发投入达4.37亿元,研发投入1.03亿元,资本化金额3.34亿元。康柏西普全球临床试验的终止很可能大幅增加资产减值和资本化研发支出确认费用化的情况,进而大幅减少净利润。这些前期投入都将面临“打水漂”的风险。
数据来源:公告
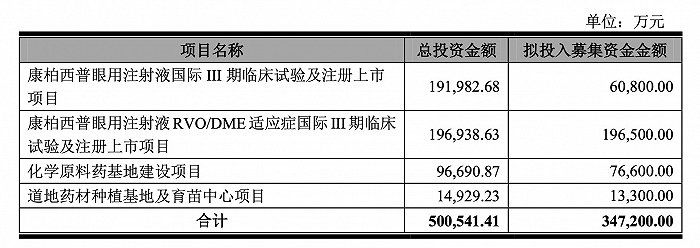
此外,康弘药业近期发布的定增方案也将出现变数。2020年12月,康弘药业发布的定增预案显示,拟募集资金34.72亿元,其中有6.08亿元和19.65亿元计划用于康柏西普国际临床试验项目,总投资金额分别达到20亿元。
国际临床试验的终止意味着后续投资计划落空,因此这项定增方案终止的可能性很大。
但康弘药业实控人、董事长柯尊洪的减持却早在2020年10月开始。2020年10月28日至11月6日,柯尊洪通过两笔大宗交易减持了康弘药业2%的股份,套现超过7亿元。
重大挫折之后,康弘药业亟需下一款“康柏西普”。





